Aritmi Tedavisi
Aritmi Tedavisi : Aritmiler, bradikardi, taşikardi ya da atriyum ve ventriküler arasındaki koordinasyonun bozulması yolu ile mekanik kardiyak işlev bozukluğuna yol açabilirler. Aritmilerin temel tedavisini farmakolojik tedavi oluşturmaktadır. Geliştirilmiş pek çok yeni antiaritmik ilacın yarar sağlamasına karşın bazı olgularda elde edilen farmakolojik etki yararlı olmamakta, bazı olgularda ise farmakolojik tedavi ie mevcut aritmi tablosu ağırlaşmakta ya da yeni ve tehlikeli aritmiler ortaya çıkabilmektedir (proaritmi).
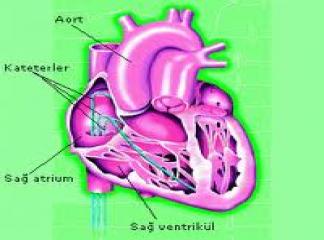
Proaritmilerin çokluğu ve tehlikesi nedeniyle pek çok kardiyolojist farmakolojik olmayan yöntemlere daha çok başvurmaya başlamıştır. Bu tür tedavi yöntemleri arasında (1) bradiaritmilerin geçici ya da kalıcı pace uygulaması ile tedavisi, (2) taşiaritmi oluşturan ektopik odakların ya da reentran yolların radyofrekans kateter yöntemi ya da cerrahi ile ablasyonu ve (3) ventrikül taşiaritmilerine bağlı olarak gelişebilen ani ölümlerin PCD‘ler ile önlenmesi yer almaktadır.
Proaritmi
İstenmeyen yan etkiler
Miyokard depresyonu
Prelod/afterlod azalması
Etkisizlik, yeterli etki elde edilemeyişi
Etkinin titrasyonunda güçlük
Etki başlamasında gecikme
Etkinin çok uzun sürmesi
Etkilerinin geri döndürülememesi
Toksisite
İstenmeyen ilaç etkileşimleri
Bradikardi/aşırı taşikardi
Kalbin normal ritmindeki bozukluklar (disritmiler) miyokardiumda elektriksel uyarı oluşumu ya da iletimindeki sorunlardan kaynaklanmaktadır. Hücresel düzeyde ise bu anormallikler membran üzerinden gerçekleşen iyon akımlarındaki işlev bozukluğuna dayanır. Miyokardın iki farklı hücre tipinden oluştuğu kabul edilebilir: çalışan miyokard hücreleri ve ileti sistemi hücreleri. Çalışan miyokard hücreleri elektriksel uyarı aldıklarında yüke karşı kısalabilen ve kalp kontraksiyonunu oluşturan hücrelerdir. Elektriksel uyarı depolarizasyon ile miyokard hücre membranının fiziksel karakterini değiştirir, membranın geçirgenliğinin artması ile de Ca hücre içine girer ve kontraktil elemanları aktive eder. Miyokard hücrelerinin kontraktil eforu birbiriyle uyumlu olmadıkça kalbin kontraksiyonu gerçekleşmez. İleti sisteminin hücreleri de bu koordinasyonu sağlar. Uyarının oluşumu, iletimi, depolarizasyon ve repolarizasyon sürecindeki aksaklıklar kardiyak aritmileri oluşturur.
ARİTMİ OLUŞUMUNUN MEKANİZMASI
Elektrofizyoloji
Normal ya da anormal kardiyak aktivite oluşturan elektriksel impulsların otomatisiteye, iletime ya da ikisine birden ait olduğu söylenebilir. Otomatisite normal kalp hızını (kronotropi) düzenler ve SA düğümde ya da iletimde yetersizlik olduğunda daha alt düzeydeki uyarı oluşturabilen merkezlerin frekansının artmasına neden olabilir. Uyarının iletim hızı (konduktivite veya dromotropi) aktivasyonun yayılımını belirleyen en önemli faktördür. İletim hızının bozulması (yavaşlaması veya hızlanması) ya da doğrudan aritmilerin oluşumundan sorumlu olur ya da “reentry” mekanizmasının başlamasına neden olur.
Anormal otomatisite, perioperatif aritmilerin en sık görülen nedenlerindendir. En basit örnekler sinüs taşikardisi ile sinüs bradikardisidir. Otomatisitedeki daha lokalize anormallikler ise izole prematüre depolarizasyonlara ya da ileti sisteminin herhangi bir yerinden kaynaklanan siklik ritmlere neden olabilir. Bu aritmilere örnek olarak kavşaktan ya da ventrikülden kaynaklanan ektopik vurular ile bunların ritm kazanmış halleri olan nodal ya da ventriküler taşikardiler verilebilir.
Anormal otomatisitenin nedenlerinin gruplandırılması mümkündür: potansiyel sonrası aritmiler, osilasyon aritmileri, tamamlanmamış repolarizasyon aritmileri ve tetiklenmiş otomatisite aritmileri. Potansiyel sonrası grubunu, faz 4 sırasında membran potansiyelindeki geçici bir azalma ile lokal potansiyel eşiğine ulaşılması durumunda gelişen depolarizasyon dalgaları oluşturur. Osilasyon ise çok sayıda potansiyel sonrası karakterli ve faz 4 potansiyelinin stabilizasyonunu bozan depolarizasyonlardan oluşur. Tamamlanmamış repolarizasyon komşu hücre grupları arasında potansiyel farkı yaratarak eşiğe ulaşacak yeterli bir akım yaratan ve depolarizasyona neden olan bir mekanizmadır. Tetiklenmiş otomatisite miyokardta ortaya çıkan otomatik bir odaktan kaynaklanmaktadır.
Anormal iletim, başlıca reentry mekanizması ile aritmi oluşumuna neden olur. Bu mekanizma ileti sisteminin herhangi bir yerinde oluşabilir ve izole ektopik kontraksiyonlar ya da yineleyen aritmiler oluşturabilir. Teorik olarak böyle bir mekanizma hem iletimi deprese olmuş hem de anormal otomatisitesi olan (gecikmiş repolarizasyon veya uzamış refraktör periyot) bir lokal miyokard alanına gereksinim duyar. Normal impuls iletimi ile iletim sisteminin komşu alanlarında depolarizasyonun eşit ve hızlı biçimde yayılımı sağlanırken repolarizasyonun geciktiği bir alanda iletimin ileri yayılımı bloke olacak impuls ise repolarizasyonu ve iletimi normal olan alanlardan aşağı doğru ilerleyecektir. Bu impulsun repolarizasyonu gecikmiş miyokard sahasını aktive etmek üzere geriye doğru iletilmesi normal miyokard alanlarını normalde refraktör periyotta olmaları nedeniyle etkilemez. Fakat impulsun aşağı iletimi bloke edilmeyip yalnızca yavaşlatılırsa (anormal ileti) impuls daha önce refraktör periyodta olduğu için bloke edildiği normal miyokard alanına retrograd olarak ulaşıp prematüre bir depolarizasyona yol açabilir.
Aritmi gelişiminden sorumlu bir diğer mekanizma da parasistoldür ve kendiliğinden aktive olan ve bağımsız olarak tetiklenmiş impulsların miyokardı aktive etmesidir. Reentry mekanizması gibi parasistol de iletimin değişmesine bağlıdır ancak anormal otomatisitenin anormal parasistolik bir impuls üretmesi de mümkündür. Parasistolik impuls üreten alan, normal bir impulsun depolarizasyonundan tek yönlü bir blok ile korunur.
ANTİARİTMİK İLAÇ TEDAVİSİ
Antiaritmik ilaçların elektrofizyolojik ve farmakolojik sınıflandırılmasında en sık kullanılan model Vaughan Williams‘ın tanımladığı modeldir (Tablo 6-3). Ancak bu sınıflamada yer alan ilaçların bazı farmakolojik ve elektrofizyolojik etkileri diğer gruplara sarkabilir. Ya da alinidin gibi yeni antiaritmik ilaçlar farklı sınıflar oluşturmak üzere bu listeye eklenebilir.
Kardiyak Glikozidler
Bu gruptaki ilaçların başlıca kullanımı, kalbin kontraksiyon gücünü arttırmak iken AF ve atriyal flutter sırasında ventrikül yanıtının hızını azaltan etkileri de yararlı olmaktadır. Pozitif inotropik etkisinde olduğu gibi antiaritmik etkisi de doğrudan ve dolaylı mekanizmalar içerir.
Dijitalin başlıca farmakolojik etkisi membrana bağlı Na+-K+ bağımlı ATPaz enziminin inhibisyonudur. Bu enzim repolarizasyon sırasında sodyum-potasyum transportu için gereken kimyasal enerjiyi sağlamaktadır. Glikozidler doyurulabilir bir şekilde enzime bağlanarak aktivitesini inhibe eder ve aktif Na+-K+ transportunu bozar. Sonuçta intrasellüler Na miktarı bir miktar artarken intrasellüler potasyum konsantrasyonu azalır.
Digoksin, Purkinje liflerinde faz 4 repolarizasyonun eğimini arttırır ve istirahat potansiyelini ya da maksimal diyastolik potansiyeli azaltarak depolarizasyonun daha az negatif potansiyel ile başlamasına neden olur. Faz 4 etkisi ekstrasellüler potasyum konsantrasyonu ile ters orantılıdır. Düşük potasyum konsantrasyonlarında faz 4 depolarizasyon hızındaki artış fazlalaşır ve otomatisite daha da artar. Bu özellik hipokalemide veya kardiyoversiyon sonrasında ya da CPB‘tan hemen sonra digoksine bağlı olarak ortaya çıkan toksisite riskindeki artışı açıklayabilir. Toksisiteye yaklaşan konsantrasyonlarda digoksin afterpotansiyellerde gecikme oluşturarak depolarizasyon tetikleyebilir. Bu nedenle tedavi edici konsantrasyonlarda digoksinin Purkinje fibrillerindeki doğrudan etkisi, ERP‘yı arttırmak ve ileti hızını azaltmaktır.
SA ve AV düğümlerdeki özel ileti fibrillerinden de benzer etkiler oluşurken baskın olan etki otonom sinir sistemi yolu ile ya da dolaylı olmaktadır. Atriyum ve ventrikül kasındaki doğrudan etkisi Purkinje liflerindeki gibidir. Dolaylı etkileri ise APD‘da azalma, QT intervalindeki kısalmayı açıklar. Aksiyon potansiyelinin faz 2 ve 3‘teki etkileri de ST segmentinin ters dönmesini açıklar.
AV düğüm, ileti sisteminin digoksinin etkileerinden en çok etkilenen parçasıdır. İletinin AV düğüm üzerinden hızı azalır. AV düğümdeki ERP digoksin ile uzar. Toksik konsantrasyonlarda digoksin AV nodal iletimi bloke edebilir.
Atriyal dokularda digoksinin doğrudan ve dolaylı (vagal) etkileri zıttır. Doğrudan etki APD‘de bir artış iken dolaylı etki (Ach salınımı ile oluşan) APD ve ERP‘de anlamlı bir azalmadır. Terapötik konsantrasyonda ise dolaylı etki baskındır. AV düğüme ulaşan atriyal impulsların frekansı genellikle azalır.
Adenozin
Adenozin potent elektrofizyolojik etkileri olan ve vazomotor tonusun düzenlenmesinde önemli fizyolojik rolü bulunan endojen bir nükleotidtir. Diğer antiaritmiklerden farklı olarak adenozin monofosfatın (AMP) bir ara metaboliti olup vücutta oluşur. Adenozin deaminaz enzimi ile inozine ya da adenozin kinaz ile AMP‘ye hızlı bir şekilde metabolize edildiğinden eliminasyon yarı ömrü 1-2 sn kadardır. Her iki enzim de intrasellüler kompartmanda yer alır ve adenozin için hızlı bir transmembran transport sistemi oluştururlar. Bu transport sisteminin dipridamol ile inhibe edilmesi adenozinin kardiyak etkilerini arttırır. Adenozinin kalp üzerindeki etkilerini G proteinleri olarak isimlendirilen proteinlere bağlanan guanin nükleotidine bağlı spesifik membran reseptörleri ile etkileşerek ortaya koyarlar.
Adenozinin en önemli kardiyak elektrofizyolojik etkileri negatif kronotropi, dromotropi ve inotropi, A1 reseptörleri üzerinden oluşur. Adenozin, SA düğümün aktivitesini, AV düğümün iletim hızını ve ventrikül otomatisitesini azaltır. Bu etkileri Ach‘e benzer.
Alinidin
Vaughan-Williams sınıflamasında yer almayan yeni bir antiaritmik ilaç sınıfını oluşturur. Spesifik bradikardik ilaçlar olarak bilinen bu gruptaki ilaçlar spontan diyastolik repolarizasyon hızını azaltır, maksimal diyastolik potansiyel ve özellikle SA düğüm hücrelerindeki APD‘ı arttırırlar. Etki mekanizmalarında membran reseptörleri yer almaz, hücre içine olan diyastolik akımların Cl- iyonlarınca antagonize edilmesi ile oluşur gibi görünmektedir. Klonidin alinidinin yıkım ürünlerindendir. Ancak alinidinin antiaritmik etkisi metabolizması gerçekleşmeden önce oluşmaktadır. Kronik tedavide ise klonidin birikimi önemli olabilir. Özellikle KAH‘larında perioperati aritmi kontrolünde kalp hızının azaltılmasında ve miyokardın kan akımının yeniden dağılımının düzenlenmesinde gelecekte önemli bir rolü olabilir.
KLAS I İLAÇLAR: Membran stabilizörleri, Sodyum kanal etkileri
Farmakolojik olarak farklı bir grup olmakla birlikte bu sınıftaki ilaçlar sodyum iyonları ile taşınan hızlı içe doğru depolarizan akımı inhibe ederler. Yeterli konsantrasyonda mebran stabilize edici etkileri bulunduğundan bazan lokal anestezik olarak da isimlendirilirler. Diğer etkilerinin farklı oluşu nedeniyle alt sınıflara ayrılarak incelenirler (Tablo 6-4).
Sodyum kanallarındaki hızlı içe ve dışa doğru akımın depresyonunun bu ilaçların primer antiaritmik etki mekanizmasını oluşturduğu kuşkuludur. Diğer olası bir mekanizma da reentry yolundaki iletiyi düzelterek reentry‘i kırmasıdır. AP‘in refraktör periyodunu kısaltmak yolu ile prematür vuruların iletimini arttırarak kendisi de reentry‘e neden olabilir.
Klas I grubu ilaçların ek olarak klinik önem taşıyan bir özellikleri daha bulunmaktadır. Kinidin ve dizopiramid ile görülen antikolinerjik etki, mesane çıkışında obstrüksiyon (dizopiramid) ve gastrointestinal semptomlar (kinidin) gibi nonkardiyak antimuskarinik etkilerin çoğundan sorumludur. Ayrıca AV düğümdeki tonik vagal aktiviteyi kaldıran antikolinerjik etkileri de AV düğümdeki iletiyi kolaylaştırarak SVT‘lerdeki tedavi edici etkisini önleyebilir. Aksine altta yatan anlamlı bir vagal etki olmadığında her iki ilaç da AV nodal blok oluşturabilir.
Bazı klas I ilaçlar ile SSS toksisitesi gelişebilir. Örneğin konvülsiyonlar gibi SSS anormallikleri lidokainin başlıca toksik etkisidir ve tokainid ve meksiletin gibi kimyasal akrabalarınınkine yakındır. Metabolizma, atılım ve metabolitlerinin farmakolojik aktiviteleri yönünden de birbirlerinden farklılık gösterebilirler. Örneğin oral kullanımında hızlı hepatik metabolizması nedeniyle lidokainin birikimi ve toksisitesi önlenmiş olur.
Klas IA
Kinidin
Tablo 6-4‘te özetlenen elektrofizyolojik etkilerine ek olarak kinidin düşük konsantrasyonda faz 4 diyastolik depolarizasyonun eğimini azaltabilir, yüksek konsantrasyonlarda da potansiyel eşiğini arttırabilir. Kinidin kardiyak kontraktiliteyi deprese eder. Bu özelliği dolaylı a adrenerjik blok ile birleştiğinde kan basıncını azaltabilir. Bu hipotansif etki, kinidinin iv uygulanmasını kısıtlayan başlıca nedendir.
Proaritmilerin çokluğu ve tehlikesi nedeniyle pek çok kardiyolojist farmakolojik olmayan yöntemlere daha çok başvurmaya başlamıştır. Bu tür tedavi yöntemleri arasında (1) bradiaritmilerin geçici ya da kalıcı pace uygulaması ile tedavisi, (2) taşiaritmi oluşturan ektopik odakların ya da reentran yolların radyofrekans kateter yöntemi ya da cerrahi ile ablasyonu ve (3) ventrikül taşiaritmilerine bağlı olarak gelişebilen ani ölümlerin PCD‘ler ile önlenmesi yer almaktadır.
Proaritmi
İstenmeyen yan etkiler
Miyokard depresyonu
Prelod/afterlod azalması
Etkisizlik, yeterli etki elde edilemeyişi
Etkinin titrasyonunda güçlük
Etki başlamasında gecikme
Etkinin çok uzun sürmesi
Etkilerinin geri döndürülememesi
Toksisite
İstenmeyen ilaç etkileşimleri
Bradikardi/aşırı taşikardi
Kalbin normal ritmindeki bozukluklar (disritmiler) miyokardiumda elektriksel uyarı oluşumu ya da iletimindeki sorunlardan kaynaklanmaktadır. Hücresel düzeyde ise bu anormallikler membran üzerinden gerçekleşen iyon akımlarındaki işlev bozukluğuna dayanır. Miyokardın iki farklı hücre tipinden oluştuğu kabul edilebilir: çalışan miyokard hücreleri ve ileti sistemi hücreleri. Çalışan miyokard hücreleri elektriksel uyarı aldıklarında yüke karşı kısalabilen ve kalp kontraksiyonunu oluşturan hücrelerdir. Elektriksel uyarı depolarizasyon ile miyokard hücre membranının fiziksel karakterini değiştirir, membranın geçirgenliğinin artması ile de Ca hücre içine girer ve kontraktil elemanları aktive eder. Miyokard hücrelerinin kontraktil eforu birbiriyle uyumlu olmadıkça kalbin kontraksiyonu gerçekleşmez. İleti sisteminin hücreleri de bu koordinasyonu sağlar. Uyarının oluşumu, iletimi, depolarizasyon ve repolarizasyon sürecindeki aksaklıklar kardiyak aritmileri oluşturur.
ARİTMİ OLUŞUMUNUN MEKANİZMASI
Elektrofizyoloji
Normal ya da anormal kardiyak aktivite oluşturan elektriksel impulsların otomatisiteye, iletime ya da ikisine birden ait olduğu söylenebilir. Otomatisite normal kalp hızını (kronotropi) düzenler ve SA düğümde ya da iletimde yetersizlik olduğunda daha alt düzeydeki uyarı oluşturabilen merkezlerin frekansının artmasına neden olabilir. Uyarının iletim hızı (konduktivite veya dromotropi) aktivasyonun yayılımını belirleyen en önemli faktördür. İletim hızının bozulması (yavaşlaması veya hızlanması) ya da doğrudan aritmilerin oluşumundan sorumlu olur ya da “reentry” mekanizmasının başlamasına neden olur.
Anormal otomatisite, perioperatif aritmilerin en sık görülen nedenlerindendir. En basit örnekler sinüs taşikardisi ile sinüs bradikardisidir. Otomatisitedeki daha lokalize anormallikler ise izole prematüre depolarizasyonlara ya da ileti sisteminin herhangi bir yerinden kaynaklanan siklik ritmlere neden olabilir. Bu aritmilere örnek olarak kavşaktan ya da ventrikülden kaynaklanan ektopik vurular ile bunların ritm kazanmış halleri olan nodal ya da ventriküler taşikardiler verilebilir.
Anormal otomatisitenin nedenlerinin gruplandırılması mümkündür: potansiyel sonrası aritmiler, osilasyon aritmileri, tamamlanmamış repolarizasyon aritmileri ve tetiklenmiş otomatisite aritmileri. Potansiyel sonrası grubunu, faz 4 sırasında membran potansiyelindeki geçici bir azalma ile lokal potansiyel eşiğine ulaşılması durumunda gelişen depolarizasyon dalgaları oluşturur. Osilasyon ise çok sayıda potansiyel sonrası karakterli ve faz 4 potansiyelinin stabilizasyonunu bozan depolarizasyonlardan oluşur. Tamamlanmamış repolarizasyon komşu hücre grupları arasında potansiyel farkı yaratarak eşiğe ulaşacak yeterli bir akım yaratan ve depolarizasyona neden olan bir mekanizmadır. Tetiklenmiş otomatisite miyokardta ortaya çıkan otomatik bir odaktan kaynaklanmaktadır.
Anormal iletim, başlıca reentry mekanizması ile aritmi oluşumuna neden olur. Bu mekanizma ileti sisteminin herhangi bir yerinde oluşabilir ve izole ektopik kontraksiyonlar ya da yineleyen aritmiler oluşturabilir. Teorik olarak böyle bir mekanizma hem iletimi deprese olmuş hem de anormal otomatisitesi olan (gecikmiş repolarizasyon veya uzamış refraktör periyot) bir lokal miyokard alanına gereksinim duyar. Normal impuls iletimi ile iletim sisteminin komşu alanlarında depolarizasyonun eşit ve hızlı biçimde yayılımı sağlanırken repolarizasyonun geciktiği bir alanda iletimin ileri yayılımı bloke olacak impuls ise repolarizasyonu ve iletimi normal olan alanlardan aşağı doğru ilerleyecektir. Bu impulsun repolarizasyonu gecikmiş miyokard sahasını aktive etmek üzere geriye doğru iletilmesi normal miyokard alanlarını normalde refraktör periyotta olmaları nedeniyle etkilemez. Fakat impulsun aşağı iletimi bloke edilmeyip yalnızca yavaşlatılırsa (anormal ileti) impuls daha önce refraktör periyodta olduğu için bloke edildiği normal miyokard alanına retrograd olarak ulaşıp prematüre bir depolarizasyona yol açabilir.
Aritmi gelişiminden sorumlu bir diğer mekanizma da parasistoldür ve kendiliğinden aktive olan ve bağımsız olarak tetiklenmiş impulsların miyokardı aktive etmesidir. Reentry mekanizması gibi parasistol de iletimin değişmesine bağlıdır ancak anormal otomatisitenin anormal parasistolik bir impuls üretmesi de mümkündür. Parasistolik impuls üreten alan, normal bir impulsun depolarizasyonundan tek yönlü bir blok ile korunur.
ANTİARİTMİK İLAÇ TEDAVİSİ
Antiaritmik ilaçların elektrofizyolojik ve farmakolojik sınıflandırılmasında en sık kullanılan model Vaughan Williams‘ın tanımladığı modeldir (Tablo 6-3). Ancak bu sınıflamada yer alan ilaçların bazı farmakolojik ve elektrofizyolojik etkileri diğer gruplara sarkabilir. Ya da alinidin gibi yeni antiaritmik ilaçlar farklı sınıflar oluşturmak üzere bu listeye eklenebilir.
Kardiyak Glikozidler
Bu gruptaki ilaçların başlıca kullanımı, kalbin kontraksiyon gücünü arttırmak iken AF ve atriyal flutter sırasında ventrikül yanıtının hızını azaltan etkileri de yararlı olmaktadır. Pozitif inotropik etkisinde olduğu gibi antiaritmik etkisi de doğrudan ve dolaylı mekanizmalar içerir.
Dijitalin başlıca farmakolojik etkisi membrana bağlı Na+-K+ bağımlı ATPaz enziminin inhibisyonudur. Bu enzim repolarizasyon sırasında sodyum-potasyum transportu için gereken kimyasal enerjiyi sağlamaktadır. Glikozidler doyurulabilir bir şekilde enzime bağlanarak aktivitesini inhibe eder ve aktif Na+-K+ transportunu bozar. Sonuçta intrasellüler Na miktarı bir miktar artarken intrasellüler potasyum konsantrasyonu azalır.
Digoksin, Purkinje liflerinde faz 4 repolarizasyonun eğimini arttırır ve istirahat potansiyelini ya da maksimal diyastolik potansiyeli azaltarak depolarizasyonun daha az negatif potansiyel ile başlamasına neden olur. Faz 4 etkisi ekstrasellüler potasyum konsantrasyonu ile ters orantılıdır. Düşük potasyum konsantrasyonlarında faz 4 depolarizasyon hızındaki artış fazlalaşır ve otomatisite daha da artar. Bu özellik hipokalemide veya kardiyoversiyon sonrasında ya da CPB‘tan hemen sonra digoksine bağlı olarak ortaya çıkan toksisite riskindeki artışı açıklayabilir. Toksisiteye yaklaşan konsantrasyonlarda digoksin afterpotansiyellerde gecikme oluşturarak depolarizasyon tetikleyebilir. Bu nedenle tedavi edici konsantrasyonlarda digoksinin Purkinje fibrillerindeki doğrudan etkisi, ERP‘yı arttırmak ve ileti hızını azaltmaktır.
SA ve AV düğümlerdeki özel ileti fibrillerinden de benzer etkiler oluşurken baskın olan etki otonom sinir sistemi yolu ile ya da dolaylı olmaktadır. Atriyum ve ventrikül kasındaki doğrudan etkisi Purkinje liflerindeki gibidir. Dolaylı etkileri ise APD‘da azalma, QT intervalindeki kısalmayı açıklar. Aksiyon potansiyelinin faz 2 ve 3‘teki etkileri de ST segmentinin ters dönmesini açıklar.
AV düğüm, ileti sisteminin digoksinin etkileerinden en çok etkilenen parçasıdır. İletinin AV düğüm üzerinden hızı azalır. AV düğümdeki ERP digoksin ile uzar. Toksik konsantrasyonlarda digoksin AV nodal iletimi bloke edebilir.
Atriyal dokularda digoksinin doğrudan ve dolaylı (vagal) etkileri zıttır. Doğrudan etki APD‘de bir artış iken dolaylı etki (Ach salınımı ile oluşan) APD ve ERP‘de anlamlı bir azalmadır. Terapötik konsantrasyonda ise dolaylı etki baskındır. AV düğüme ulaşan atriyal impulsların frekansı genellikle azalır.
Adenozin
Adenozin potent elektrofizyolojik etkileri olan ve vazomotor tonusun düzenlenmesinde önemli fizyolojik rolü bulunan endojen bir nükleotidtir. Diğer antiaritmiklerden farklı olarak adenozin monofosfatın (AMP) bir ara metaboliti olup vücutta oluşur. Adenozin deaminaz enzimi ile inozine ya da adenozin kinaz ile AMP‘ye hızlı bir şekilde metabolize edildiğinden eliminasyon yarı ömrü 1-2 sn kadardır. Her iki enzim de intrasellüler kompartmanda yer alır ve adenozin için hızlı bir transmembran transport sistemi oluştururlar. Bu transport sisteminin dipridamol ile inhibe edilmesi adenozinin kardiyak etkilerini arttırır. Adenozinin kalp üzerindeki etkilerini G proteinleri olarak isimlendirilen proteinlere bağlanan guanin nükleotidine bağlı spesifik membran reseptörleri ile etkileşerek ortaya koyarlar.
Adenozinin en önemli kardiyak elektrofizyolojik etkileri negatif kronotropi, dromotropi ve inotropi, A1 reseptörleri üzerinden oluşur. Adenozin, SA düğümün aktivitesini, AV düğümün iletim hızını ve ventrikül otomatisitesini azaltır. Bu etkileri Ach‘e benzer.
Alinidin
Vaughan-Williams sınıflamasında yer almayan yeni bir antiaritmik ilaç sınıfını oluşturur. Spesifik bradikardik ilaçlar olarak bilinen bu gruptaki ilaçlar spontan diyastolik repolarizasyon hızını azaltır, maksimal diyastolik potansiyel ve özellikle SA düğüm hücrelerindeki APD‘ı arttırırlar. Etki mekanizmalarında membran reseptörleri yer almaz, hücre içine olan diyastolik akımların Cl- iyonlarınca antagonize edilmesi ile oluşur gibi görünmektedir. Klonidin alinidinin yıkım ürünlerindendir. Ancak alinidinin antiaritmik etkisi metabolizması gerçekleşmeden önce oluşmaktadır. Kronik tedavide ise klonidin birikimi önemli olabilir. Özellikle KAH‘larında perioperati aritmi kontrolünde kalp hızının azaltılmasında ve miyokardın kan akımının yeniden dağılımının düzenlenmesinde gelecekte önemli bir rolü olabilir.
KLAS I İLAÇLAR: Membran stabilizörleri, Sodyum kanal etkileri
Farmakolojik olarak farklı bir grup olmakla birlikte bu sınıftaki ilaçlar sodyum iyonları ile taşınan hızlı içe doğru depolarizan akımı inhibe ederler. Yeterli konsantrasyonda mebran stabilize edici etkileri bulunduğundan bazan lokal anestezik olarak da isimlendirilirler. Diğer etkilerinin farklı oluşu nedeniyle alt sınıflara ayrılarak incelenirler (Tablo 6-4).
Sodyum kanallarındaki hızlı içe ve dışa doğru akımın depresyonunun bu ilaçların primer antiaritmik etki mekanizmasını oluşturduğu kuşkuludur. Diğer olası bir mekanizma da reentry yolundaki iletiyi düzelterek reentry‘i kırmasıdır. AP‘in refraktör periyodunu kısaltmak yolu ile prematür vuruların iletimini arttırarak kendisi de reentry‘e neden olabilir.
Klas I grubu ilaçların ek olarak klinik önem taşıyan bir özellikleri daha bulunmaktadır. Kinidin ve dizopiramid ile görülen antikolinerjik etki, mesane çıkışında obstrüksiyon (dizopiramid) ve gastrointestinal semptomlar (kinidin) gibi nonkardiyak antimuskarinik etkilerin çoğundan sorumludur. Ayrıca AV düğümdeki tonik vagal aktiviteyi kaldıran antikolinerjik etkileri de AV düğümdeki iletiyi kolaylaştırarak SVT‘lerdeki tedavi edici etkisini önleyebilir. Aksine altta yatan anlamlı bir vagal etki olmadığında her iki ilaç da AV nodal blok oluşturabilir.
Bazı klas I ilaçlar ile SSS toksisitesi gelişebilir. Örneğin konvülsiyonlar gibi SSS anormallikleri lidokainin başlıca toksik etkisidir ve tokainid ve meksiletin gibi kimyasal akrabalarınınkine yakındır. Metabolizma, atılım ve metabolitlerinin farmakolojik aktiviteleri yönünden de birbirlerinden farklılık gösterebilirler. Örneğin oral kullanımında hızlı hepatik metabolizması nedeniyle lidokainin birikimi ve toksisitesi önlenmiş olur.
Klas IA
Kinidin
Tablo 6-4‘te özetlenen elektrofizyolojik etkilerine ek olarak kinidin düşük konsantrasyonda faz 4 diyastolik depolarizasyonun eğimini azaltabilir, yüksek konsantrasyonlarda da potansiyel eşiğini arttırabilir. Kinidin kardiyak kontraktiliteyi deprese eder. Bu özelliği dolaylı a adrenerjik blok ile birleştiğinde kan basıncını azaltabilir. Bu hipotansif etki, kinidinin iv uygulanmasını kısıtlayan başlıca nedendir.